ЭКСПЕРИМЕНТАЛЬНАЯ ОЦЕНКА ВЛИЯНИЯ ПРЕПАРАТА КАГОЦЕЛ НА ГЕНЕРАТИВНУЮ ФУНКЦИЮ КРЫС-САМЦОВ ПУБЕРТАТНОГО ВОЗРАСТА
Изучено возможное токсическое действие противовирусного препарата «Кагоцел» на репродуктивную систему крыс-самцов пубертатного возраста. Лекарственное средство вводили в течение всего цикла сперматогенеза (48 дней) в терапевтической дозе и в 10 раз ее превышающей. Установлено, что кагоцел не снижает способность животных к спариванию и к оплодотворению, не угнетает сперматогенез, не оказывает токсического влияния на потомство. Полученные данные характеризуют кагоцел как препарат с широким профилем репродуктивной безопасности и свидетельствуют о том, что возрастные границы использования кагоцела в педиатрической практике могут быть расширены.
Ключевые слова: противовирусный препарат кагоцел, генеративная функция крыс-самцов, пубертатный возраст.
Адрес для корреспонденции: repropharm@yandex.ru. Боровская Т.Г.
Противовирусный препарат «Кагоцел» широко применяется в России для профилактики и лечения ОРВИ, гриппа и герпеса. Препарат относится к группе индукторов интерферона. Его действующее вещество является продуктом химического синтеза, в котором к полимерной полисахаридной матрице (карбоксиметилцеллюлозе) ковалентно присоединены молекулы госсипола (природного полифенольного пигмента хлопчатника), обладающего противовирусной активностью. Данные литературы свидетельствуют о том, что госсипол подавляет мужскую репродуктивную функцию 4. В ранее проведенных исследованиях по изучению влияния кагоцела на генеративную функцию половозрелых крыс-самцов установлено, что препарат не приводит к угнетению сперматогенеза, снижению плодовитости животных и не оказывает негативного влияния на их потомство 3. Кагоцел показан к применению у детей в возрасте от 3 лет. Планируется расширение возрастных границ для применения препарата в педиатрической практике. Данные литературы свидетельствует о том, что семенники в период полового созревания обладают повышенной чувствительностью к токсическим воздействиям 1.
Целью данной работы являлось изучение влияния препарата «Кагоцел» на репродуктивную функцию крыс-самцов пубертатного возраста.
МЕТОДИКА ИССЛЕДОВАНИЯ
Эксперименты проведены на белых аутбредных крысах-самцах Вистар (n=60) в возрасте 52-54 дня, разделенных на 3 группы: контрольную (n=15), плацебо (n=15) и получавшую кагоцел (n=30). Для спаривания использовали интактных половозрелых крыс-самок (n=64). Крыс содержали в соответствии с правилами Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 1986). Кагоцел вводили в дозах 6 мг/кг (терапевтическая) и 60 мг/кг (высшая доза, превышающая терапевтическую в 10 раз). Растворитель, 1% крахмальный гель (контрольная группа), использовали в количестве, эквивалентном высшей дозе исследуемого препарата. Плацебо вводили аналогичным способом в дозе, соответствующей содержанию вспомогательных веществ в высшей (60 мг/кг) дозе кагоцела, что составляет 440 мг/кг. Все исследуемые вещества (препарат, плацебо, растворитель) вводили внутрижелудочно с помощью зонда один раз в сутки, в течение 48 сут. Через 1 сут после окончания введения часть крыс-самцов каждой группы (n=7) подвергали эвтаназии. У этих животных выделяли семенники и эпидидимис, определяли их массу и вычисляли весовой коэффициент. Половые железы фиксировали в 10% формалине, заливали в парафин, готовили парафиновые срезы толщиной 6-7 мкм, которые окрашивали гематоксилином и эозином. Морфологическую оценку состояния сперматогенного эпителия проводили по следующим количественным показателям: индекс сперматогенеза, среднее количество нормальных сперматогоний, относительное количество канальцев с 12-й стадией мейоза 2. Оставшихся животных (n=8) подсаживали к интактным самкам в соотношении 1:2 на 10 сут для оценки способности к оплодотворению и зачатию 2. Крыс-самок на 20-й день беременности подвергали СО2-эвтаназии. Подсчитывали количество желтых тел в яичниках, живых и мертвых плодов в матке. На основании полученных данных вычисляли индексы плодовитости и беременности, а также показатели пре- и постимплантационной гибели. Индекс плодовитости определяли по отношению количества подсаженных самок к количеству оплодотворенных, индекс беременности — по количеству оплодотворенных и беременных самок. Преимплантационную смертность вычисляли по разности между количеством желтых тел в яичниках и количеством мест имплантации в матке, постимплантационную смертность — по разности между количеством мест имплантации и количеством живых плодов. В связи с тем, что у всех млекопитающих в норме часть эмбрионов погибает до и после имплантации, при анализе и сопоставлении показателей эмбриональной гибели были использованы обобщенные архивные данные контрольных групп из ранее проведенных исследований («обобщенный» контроль). Необходимость использования этой группы обоснована в руководстве по доклиническим исследованиям средств медицинского применения 2. В дальнейшем плоды выделяли, определяли их массу, краниокау-дальный размер, пол. Проводили макроскопический осмотр плодов, исследовали состояние их внутренних органов (по методу Вильсона) 2.
При статистической обработке полученных данных использовали U критерий Манна—Уитни и угловое преобразование Фишера.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При изучении интегральных показателей генеративной функции крыс установлено, что введение кагоцела в высшей и терапевтической дозах не приводило к статистически значимому снижению способности животных к оплодотворению и зачатию. Так, индексы плодовитости и беременности при применении препарата в терапевтической и высшей дозах (75 и 75%, 93.75 и 73.33%) находились на уровне таковых в группах контроля (81.25 и 92.31%) и плацебо (81.25 и 92.31%).
Количество желтых тел в яичниках, мест имплантации и живых плодов в матке во всех исследуемых группах животных статистически значимо не различались. Масса, размер плодов, распределение их по полу во всех сравниваемых группах оказались сходными (табл. 1). Результаты определения величин показателей эмбриональной гибели показали, что уровни пре- и постимплантационной смертности статистически значимо не отличались от контрольных значений (рис. 1, а, б). Полученные данные свидетельствуют о том, что исследуемый лекарственный препарат не вызывает в мужских половых клетках генетических нарушений, приводящих к гибели оплодотворенной яйцеклетки. При макроскопическом осмотре плодов всех исследуемых животных внешних аномалий развития выявлено не было. Однако у части плодов всех групп наблюдались наружные кровоизлияния. Количество плодов с данными патологическими изменениями в экспериментальных группах и в группах контроля и плацебо оказалось сходным (рис. 2).
| Группа | Количество | Размер плодов, мм |
Масса плодов, г |
Количество плодов, % | |||
|---|---|---|---|---|---|---|---|
| желтых тел | мест имплантации |
живых плодов |
женского пола |
мужского пола |
|||
| Кагоцел, 6 мг/кг (n=11) |
14.78±0.89 |
14.00±0.71 | 12.67±0.71 | 26.22±0.17 | 2.41±0.06 | 44.45±3.28 | 55.55±3.28 |
| Кагоцел, 60 мг/кг (n=9) |
16.09±0.88 | 14.91±0.84 | 13.36±0.98 | 26.58±0.31 | 2.19±0.04 | 49.66±2.76 | 50.34±2.76 |
| Плацебо (n=12) | 15.42±1.09 | 13.17±1.12 | 12.33±1.21 | 27.14±0.41 | 2.16±0.03 | 43.92±4.45 | 56.08±4.45 |
| Контроль (n=12) | 15.17±0.68 | 13.17±1.25 | 12.67±1.21 | 27.68±0.39 | 2.37±0.08 | 45.96±3.94 | 54.04±3.94 |
| «Обобщенный» контроль (n=10) |
16.00±0.49 | 15.40±0.82 | 14.60±0.98 | 27.88±0.32 | 2.25±0.06 | 48.36±3.89 | 51.64±3.89 |
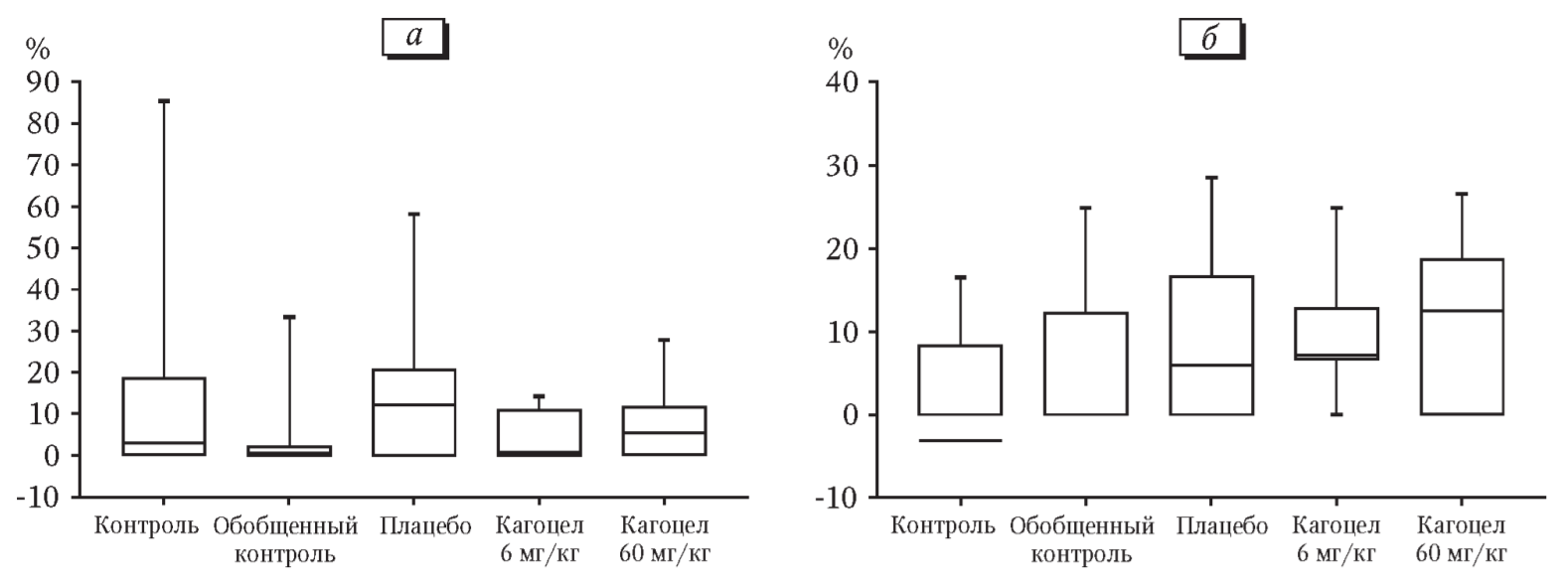
а — преимплантационная смертность, б — постимплантационная смертность.
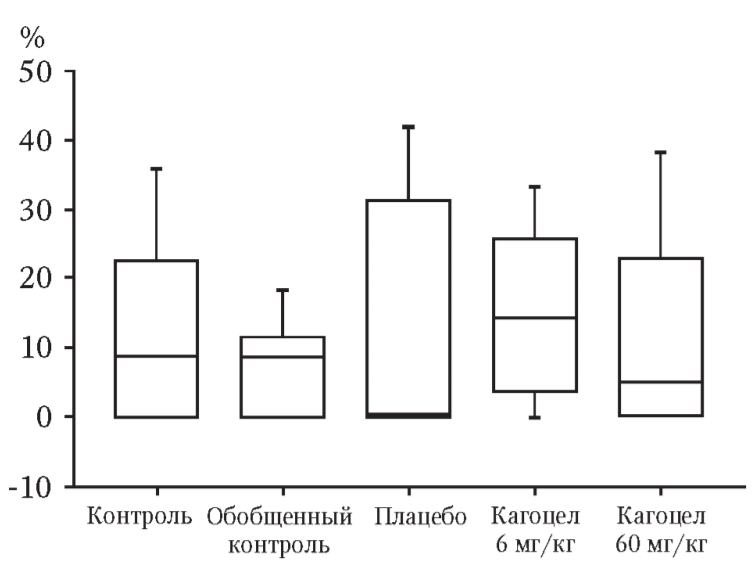
В группах контроля и плацебо выявлялись такие патологические изменения внутренних органов, как кровоизлияния в различные органы и ткани, холестаз, гидронефроз, умеренные расширения желудочков головного мозга, гемоперикард (табл. 2). В плодах интактных самок, спаренных с самцами, получавшими кагоцел в высшей и терапевтической дозах, выявлялся тот же спектр патологических изменений. Частота их встречаемости статистически значимо не отличалась от таковой в группах контроля и плацебо.
Весовые коэффициенты семенников и эпидидимисов крыс, получавших кагоцел в обеих дозах, статистически значимо не отличались от контрольных значений (табл. 3). При проведении морфологического анализа половых желез крыс-самцов установлено, что в семенниках крыс всех групп наблюдалось активное созревание мужских половых клеток. В тестикулярной ткани выявлялись сперматогонии, сперматоциты, сперматиды, сперматозоиды. В непосредственной близости от сперматогоний отмечалось наличие клеток Сертоли, одной из главных функций которых является обеспечение целостности гематотестикулярного барьера. В просвете между извитыми семенными канальцами были отчетливо видны клетки Лейдига, являющиеся, как известно, тестостеронсинтезирующими. Судя по индексу сперматогенеза, истончения сперматогенной ткани не наблюдалось (табл. 3). Количество источников пролиферативного пула сперматогенеза (сперматогоний) не снижалось. Мейотическая активность сперматоцитов находилась на уровне контрольных значений, о чем свидетельствовали результаты подсчета количества канальцев с 12-й стадией мейоза (метафаза второго деления). Полученные данные свидетельствуют об отсутствии отрицательного влияния кагоцела в терапевтической и высшей дозах на сперматогенез экспериментальных животных.
| Патологические изменения | Относительное количество плодов, % | |||
|---|---|---|---|---|
| кагоцел, 6 мг/кг |
кагоцел, 60 мг/кг |
плацебо | контроль | |
| Обширные кровоизлияния в различные органы и ткани | 6.98 | 7.14 | 5.38 | 4.85 |
| Умеренные кровоизлияния в различные органы и ткани | 20.93 | 39.29 | 34.41 | 33.98 |
| Холестаз | 29.07 | 32.00 | 8.60 | 16.50 |
| Гидронефроз | 0.00 | 1.19 | 2.15 | 1.94 |
| Умеренные расширения желудочков головного мозга | 2.33 | 2.38 | 4.30 | 2.91 |
| Гемоперикард | 58.14 | 51.19 | 44.09 | 32.04 |
| Группа | Весовой коэффициент яичка, мг/г |
Весовой коэффициент эпидидимиса, мг/г |
Количество канальцев с 12-й стадией мейоза, % |
Количество нормальных сперматогоний |
Индекс сперматогенеза, усл. ед. |
|---|---|---|---|---|---|
| Контроль | 3.42±0.19 | 0.58±0.03 | 2.43±0.30 | 16.16±0.44 | 3.97±0.01 |
| Кагоцел, 6 мг/кг | 3.62±0.11 | 0.55±0.02 | 1.86±0.14 | 16.99±0.28 | 3.97±0.00 |
| Кагоцел, 60 мг/кг | 3.88±0.07 | 0.61±0.02 | 2.00±0.38 | 15.49±0.50 | 3.96±0.00 |
| Плацебо | 3.60±0.16 | 0.59±0.02 | 2.00±0.38 | 15.95±0.38 | 3.96±0.01 |
Таким образом, введение кагоцела в терапевтической дозе и в 10 раз ее превышающей крысам-самцам пубертатного возраста не приводило к угнетению репродуктивной системы по достижении ими репродуктивного возраста. Интегральные показатели воспроизводящей функции — способность к оплодотворению и зачатию — статистически значимо не снижались. Нарушений процесса образования мужских половых клеток не выявлялось. Кагоцел не вызывал появление нежизнеспособных и/или генетически неполноценных гамет, судя по показателям эмбриональной гибели и состоянию плодов. Полученные данные характеризуют кагоцел как препарат с широким профилем репродуктивной безопасности и свидетельствуют о том, что возрастные границы использования кагоцела в педиатрической практике могут быть расширены.
ЛИТЕРАТУРА
- Винокуров А.А. Лимфома Ходжкина, проблема репродукции у мужчин // Клин. онкогематол. 2013. Т. 6, № 3. С. 258-273.
- Дурнев А.Д., Смольникова Н.М., Скосырева, Немова Е.П., Соломина А.С. Шреде О.В., Гуськова Т.А., Верстакова О.Л., Сюбаев Р.Д. Методические рекомендации по доклиническому изучению репродуктивной токсичности новых лекарственных средств // Руководство по проведению доклинических исследований лекарственных средств / Под. ред. А.Н.Миронова, Н.Д.Бунатяна. М., 2013. Ч. 1. С. 80-93.
- Рыбалкин С.П., Коновалова Е.В., Гуськова Т.А., Савинова Т.Б. Экспериментальная оценка влияния препарата Кагоцел на генеративную функцию животных // Токсикол. вестник. 2013. № 2. С. 33-38.
- de Peyster A., Wang Y.Y. Genetic toxicity studies of gossypol // Mutat. Res. 1993. Vol. 297, N 3. P. 293-312.
